Western blot (WB) sigue siendo a día de hoy el método más utilizado para separar y detectar proteínas, y a pesar de esto sigue siendo tedioso tener que poner a punto cada experimento. Optimizar nuestro experimento es crucial y factores cómo: la calidad del anticuerpo, los tampones de bloqueo o la eficiencia en la transferencia son pasos clave para tener éxito en el proceso.
Vamos a analizar con detalle qué consejos y herramientas nos van a permitir mejorar nuestros resultados.
- 1. Carga la cantidad adecuada de proteína
- 2. ¿Necesitan mis muestras ser reducidas o desnaturalizadas?
- 3. ¿Cómo evitar las temidas bandas «smiley» y los «spots«?
- 4. ¿Existe alguna diferencia entre bloquear la membrana con BSA o leche?
- 5. ¿Qué dilución de anticuerpo primario debo utilizar?
- Consulta todas las soluciones para Western blot disponibles en el catálogo de SERVA
1. Carga la cantidad adecuada de proteína
La candidad de proteína que debe cargarse en cada pocillo es variable y debe ser optimizada por el investigador ya que es un factor que depende de los niveles de expresión de ese gen en ese tejido. Además, se debe tener en cuenta qué volumen de muestra admite ese pocillo. Sin embargo, entre 10 y 50 ug de proteína procedente de homogeneizado de tejido y entre 10 y 100 ng de proteína total en muestras purificadas suele ser suficiente.
2. ¿Necesitan mis muestras ser reducidas o desnaturalizadas?
Revisar la ficha técnica del anticuerpo es esencial para saber cómo debemos preparar nuestras muestras. Habitualmente, las muestras para WB suelen ser proteínas desnaturalizadas. Las proteínas nativas presentan estructura terciaria y su conformación confiere un papel fundamental en la función de la proteína. Sin embargo, esta estructura afectará a la migración de estas proteínas a través de los poros de poliacrilamida. La desnaturalización de proteínas se puede realizar mediante:
- Dodecilsufato sódico (SDS), es un detergente que se utiliza para romper los puentes de hidrógeno y desmontar la estructura terciaria.
- Agentes reductores como el b-mercaptoetanol o el ditiotreitol (DTT) para reducir los puentes disulfuro entre cisteínas.
- Calentar las muestras a 100ºC para desnaturalizar y facilitar la unión del SDS.
3. ¿Cómo evitar las temidas bandas «smiley» y los «spots» ?
Si nuestra membrana presenta estas «bandas sonrientes», probablemente la electroforesis se debe haber realizado demasiado rápido o las muestras se han calentado demasiado. Se recomienda realizar una migración más lenta durante más tiempo y a ser posible en frío.
A veces, pueden aparecer manchas blancas en nuestro blot cómo resultado de burbujas de aire que han quedado retenidas durante el proceso de transferencia. Para evitar este problema tan molesto, recomendamos utilizar un tubo tipo cónico de 50 ml sobre el conjunto de la transferencia con la idea de eliminar el aire residual entre el gel de poliacrilamida y la membrana de nitrocelulosa o PVDF.
4. ¿Existe alguna diferencia entre bloquear con BSA o leche?

Después de transferir la proteína desde el gel de poliacrilamida hasta la membrana es esencial bloquear aquellos puntos de la membrana que no contienen ligando con la finalidad de reducir el background o unión inespecífica del anticuerpo con la membrana.
Para nosotros, es más recomendable seguir los consejos que el fabricante especifica ya que usualmente los anticuerpos pueden ser muy sensibles al tipo de agente bloqueador que se utiliza.
En general, el bloqueo con albúmina de suero bovino (BSA) aporta resultados más claros ya que esta proteína presenta una reactividad cruzada más baja. Además el uso de BSA está indicado en aquellos blots en que queramos detectar proteínas fosforiladas.
Sin embargo, muchos anticuerpos funcionan mejor con leche desnatada ya que contiene una gran diversidad de agentes bloqueantes.
5. ¿Qué dilución de anticuerpo primario debo utilizar?
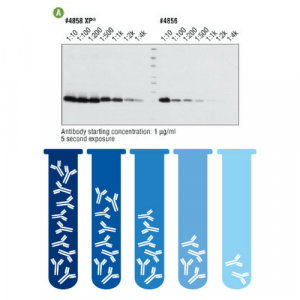 La concentración óptima de un anticuerpo es aquella por la cual obtenemos un buen señal con un mínimo ruido de fondo. Obviamente, para ahorrar, es ideal diluir nuestro anticuerpo siempre y cuando el señal sea el adecuado.
La concentración óptima de un anticuerpo es aquella por la cual obtenemos un buen señal con un mínimo ruido de fondo. Obviamente, para ahorrar, es ideal diluir nuestro anticuerpo siempre y cuando el señal sea el adecuado.
Sin embargo, con los anticuerpos nuevos, es adecuado hacer un banco de diluciones con la finalidad de conocer cual es la dilución que mejor se adapta a esa proteína en este tejido. Por ejemplo, si el fabricante sugiere una dilución 1:200, podemos testar diluciones 1:50, 1:100, 1:500 o incluso 1:1000.
En el caso en que no tengamos información adicional acerca de la dilución que debemos emplear, nos podemos orientar según estos parámetros:
- sobrenadante procedente de cultivo celular: aproximadamente 1:10
- ascitis: 1:100
- antisuero total: desde 1:50 a 1:100
- anticuerpo purificado: 5 ug/mL
Consulta todas las soluciones para Western blot que Labclinics te ofrece
Genetex te ofrece una selección de productos relacionados con Western Blot (electroforesis, transferencia, bloqueo, etc.).
¿Tienes dudas?
Si no te queda claro del todo cómo funciona esta tecnología, o quieres que te ayudemos a configurar tu ensayo, nuestro departamento técnico de especialistas, con amplia trayectoria en investigación (todos PhD), te pueden echar una mano: por mail (tecnic@labclinics.com), por tlf +34.934464700 o de forma presencial. Contáctanos y estaremos encantados de poder ayudarte!








Deja tu respuesta