El código genético es la huella de un organismo codificada en una molécula estable: el ácido desoxirribonucleico. Con el método CRISPR/Cas9, editar la información genética se ha vuelto mucho más fácil. Esta técnica es una maravilla para los científicos básicos, así como para los investigadores traslacionales.
- 1) Introducción
- 2) El sueño de curar enfermedades genéticas
- 3) Aplicaciones de esta nueva herramienta
- 4) ¿Qué enfermedades podrán ser tratadas con CRISPR?
- 5) Modificaciones no deseadas
- 6) Conclusiones
1) Introducción
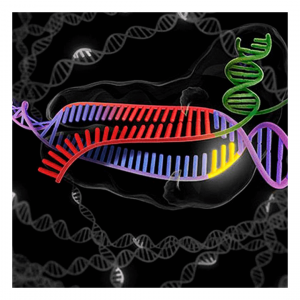
La técnica CRISPR-Cas9 ha revolucionado la edición genética. Estas tijeras moleculares, uno de los descubrimientos del año según Science en 2015 y premio Princesa de Asturias el mismo año, permiten modificar, introducir o corregir mutaciones controladas en el ADN con aplicaciones que van desde la lucha contra enfermedades hasta mejorar cultivos transgénicos. Un grupo de investigadores entorno a la Dra. Emmanuelle Charpentier y la Dra. Jennifer Doudna. Todos ellos, descubrieron una nueva herramienta para editar genes (Jinek et al., 2012). El sistema está formado por dos componentes: una hebra de nucleótidos llamada Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR), que codifica un ARN guía que es capaz de reconocer una región del ADN y una proteína llamada CRISPR asociada (Cas) que actúa como endonucleasa y utiliza el ARN guía para cortar específicamente el ADN en una región concreta. Este método innovador para editar genes es sencillo y altamente preciso.
Después de hacerse público el revolucionario trabajo de Charpentier y Doudna en la revista Science, cientos de científicos empezaron a utilizar este nuevo método en su investigación. Como consecuencia, el número de trabajos publicados conteniendo las palabras CRISPR/Cas9 en la base de datos Pubmed rápidamente aumentó desde 100 trabajos publicados en 2012 hasta 3.000 citaciones en 2017.
2) El sueño de curar enfermedades genéticas
Desde que fuera descrita por primera vez, son numerosos los hallazgos alcanzados gracias a este sistema de corta y pega. Uno de los avances, consiste en una nueva versión de la herramienta que, en lugar de editar ADN en las células humanas, lo hace sobre el ARN (Cox et al., 2017). Este método puede alterar la expresión genética sin realizar cambios en el genoma, lo que supone un gran potencial tanto para la investigación como para el tratamiento de enfermedades. Este nuevo hallazgo supone varias ventajas. Por un lado, es capaz de corregir mutaciones en diferentes ventanas de tiempo, incluso durante los períodos de desarrollo clave; y por otro, aliviaría las preocupaciones éticas asociadas con la edición del ADN.

Por otro lado, científicos del Instituto Broad – perteneciente al Instituto Tecnológico de Massachusetts (MIT) – caracterizaron subfamilias de la proteína Cas y descubrieron una versión capaz de cortar el ARN, la Cas13. El equipo, liderado por Feng Zhang, fue el primero que utilizó CRISPR para la edición del genoma de mamíferos y el que ganó la batalla por la patente de la técnica.
3) Aplicaciones de esta nueva herramienta
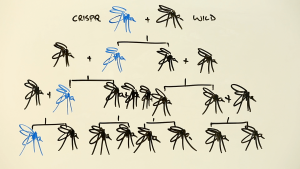 Esta nueva técnica puede ser utilizada en casi cualquier situación en que se desee modificar la secuencia de ADN. Está siendo muy útil en investigación básica para generar modelos de enfermedades que antes apenas se podían estudiar, así como para estudiar nuevas dianas y fármacos. CRISPR permite que un gen modificado se herede con una probabilidad casi del 100%, lo que puede modificar poblaciones enteras en apenas unas generaciones. Uno de los proyectos con mayor repercusión es el de alterar los mosquitos transmisores de la malaria, ya sea infertilizándolos o haciendo que actúen contra el parásito. Aunque aún no se han iniciado, estos experimentos supondrían romper la selección natural.
Esta nueva técnica puede ser utilizada en casi cualquier situación en que se desee modificar la secuencia de ADN. Está siendo muy útil en investigación básica para generar modelos de enfermedades que antes apenas se podían estudiar, así como para estudiar nuevas dianas y fármacos. CRISPR permite que un gen modificado se herede con una probabilidad casi del 100%, lo que puede modificar poblaciones enteras en apenas unas generaciones. Uno de los proyectos con mayor repercusión es el de alterar los mosquitos transmisores de la malaria, ya sea infertilizándolos o haciendo que actúen contra el parásito. Aunque aún no se han iniciado, estos experimentos supondrían romper la selección natural.
4) ¿Qué enfermedades podrán ser tratadas con CRISPR?
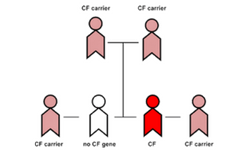
A día de hoy, la mayoría de estudios que se están llevando a cabo están centrados en enfermedades monogénicas. A día de hoy, no se ha aprobado ninguna terapia. Las enfermedades en las que más se trabaja se manifiestan en tejidos accesibles. Algunos de los ensayos clínicos que se esperan están dirigidos a la anemia de Fanconi, o la distrofia muscular de Duchenne. Sin embargo, los tratamientos en cursos están realizando en China e incluyen pacientes con cáncer sin otras opciones de tratamiento.
5) Modificaciones no deseadas

La edición genética mediante CRISPR también conlleva problemas asociados. No es rara la generación de diferentes alelos mutantes. Recientemente, se ha mostrado que se pueden generar alelos no deseados en secuencias similares. Esto, ha generado un cierto revuelo en la comunidad científica debido a las mutaciones no esperadas tras un experimento de CRISPR en modelo de ratón. Sin embargo, posteriormente se desveló que estos resultados eran producto de errores en el diseño experimental y la posterior interpretación de resultados.
6) Conclusiones
A día de hoy, CRISPR se ha convertido en una poderosa herramienta de laboratorio. Debido a su relativamente bajo precio y su también relativa facilidad de uso ha sido adoptada por miles de laboratorios de todo el mundo. Sin embargo, aún no se ha convertido en una técnica que transforme la práctica médica. Básicamente porque en investigación dos años no es casi nada para que aquello que se hace en los laboratorios se transfiera a la clínica, agricultura o industria. Pero no hay que dudar de que ese momento llegará, antes casi de que nos demos cuenta.









Deja tu respuesta