No somos conscientes de ello, pero respiramos entre 7 y 8 litros de aire al minuto. Ese aire, a parte del oxígeno con el que vivimos, también contiene partículas de polvo, contaminantes y posibles patógenos. Es trabajo de las células epiteliales presentes en nuestras vías respiratorias crear una barrera y asegurarse de que estos agentes son expulsado, para que no dañen a nuestros pulmones. Sin embargo, enfermedades pulmonares como el asma o la enfermedad pulmonar obstructiva crónica (EPOC) deterioran esta capacidad de “limpieza” del epitelio de las vías respiratorias, y las consecuencias pueden ser muy graves. ALI
Para poder estudiar lo que pasa en nuestras vías respiratorias, los investigadores necesitan replicar el entorno in vivo de la manera más parecida posible. Con los nuevos compromisos por disminuir el uso de animales en la investigación, está creciendo una búsqueda de modelos que sean fisiológicamente relevantes. Los cultivos celulares en el interfaz aire-líquido (ALI) imitan las características de las células epiteliales de las vías respiratorias y son una alternativa óptima al estudio con animales.
Los sistemas ALI proveen información relevante de los procesos fisiológicos y patológicos del tracto respiratorio, que se podrá aplicar a un gran rango de investigaciones como, la lucha contra agentes infecciosos, efectos de la polución o el efecto del tratamiento con medicamentos. Aún así, como todo sistema in vitro tiene diferentes retos a superar para poder validarse y estandarizarse con resultados reproducibles.
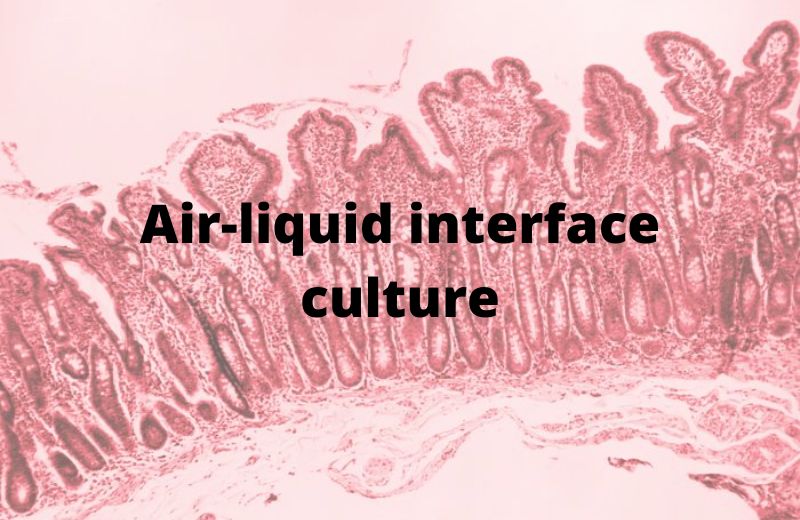
Cultivos en el interfaz aire-líquido (ALI): replicando la anatomía de los pulmones in vitro
Los 80m2 de superficie pulmonar están compuestos por diferentes tipos celulares, células caliciformes, células basales y células epiteliales ciliadas, entre otras (Miller and Spence, 2017). Esto es debido a las diferentes tareas que debe llevar a cabo el epitelio de las vías aéreas. Lidiar con los hasta 25 millones de partículas inhaladas. Las células caliciformes y las glándulas seromucosas producen moco, y ese gel viscoelástico forma una capa protectora que atrapa a los microorganismos.
El mecanismo mucociliar transporta cualquier partícula foránea a la boca para eliminarla (Rogers, 2007). Las células epiteliales producen diversas citoquinas que participan en los mecanismos de la respuesta inmune innata y adaptativa (Mertens et al., 2017).

Debido a esa gran cantidad de tareas que desarrollan las células epiteliales, establecer un sistema in vitro que funcione de forma similar es difícil. Los cultivos en 2D presentan varias desventajas, cómo la pérdida de la arquitectura del tejido, la ausencia de diferenciación celular y el daño en la integridad de la barrera. Todas ellas son características relevantes en el estudio de las enfermedades de las vías respiratorias. En cultivos in vitro 2D, donde las células muestran una rápida desdiferenciación, alta senescencia y baja proliferación (Ramirez et al., 2004).
Por todo ello, los cultivos de 3D de células epiteliales de las vías respiratorias humanas han ido ganando interés últimamente. Los sistemas de cultivo ALI logran superar muchos de los desafíos de los cultivos 2D y tienen muchas ventajas respecto a los medios de cultivo sumergidos. Los cultivos ALI exhiben una morfología pseudoestratificada, experimentan diferenciación mucociliar, secretan mucina y forman uniones estrechas. Además, el entorno extracelular es similar a las condiciones in vivo (Lacroix et al., 2018).
Cultivos ALI: poderosos modelos de las vías respiratorias humanas
Los cultivos celulares realizados en la interfaz aire-líquido (ALI) facilitan el establecimiento de unos modelos 3D del tracto respiratorio estables y funcionales. En estos modelos, el lado basal de las células esta en contacto con el medio de cultivo y el lado apical está en contacto con el aire. Por lo tanto, se crea un escenario in vitro muy parecido a lo que pasa in vivo.
Para establecer cultivos ALI, las células epiteliales primarias se siembran primero en recipientes de cultivo de plástico, donde pueden expandirse hasta alcanzar una confluencia del 70-80%. Después de esta primera fase de expansión 2D, las células se transfieren a sistemas de cultivo compartimentados en membranas porosas. Entonces, las células se sumergen en medio de cultivo y comienzan a proliferar en 3D hasta llegar a la confluencia. Finalmente, son elevados, es decir, expuestos al aire circundante, y el suministro nutritivo se proporciona solo en el polo celular basolateral. Este sistema permite la diferenciación celular morfológica y funcional y la formación de un epitelio pseudoestratificado con polaridad basoapical completa.
El epitelio reconstituido muestra muchas características observadas in vivo, como la producción de cilios y moco (Chen and Schoen, 2019).
Estandarización: un requisito clave para crear sistemas ALI de cultivo relevantes
La estandarización y validación de métodos basados en material humano se vuelven aún más importantes cuando los resultados de la investigación tienen relevancia clínica. El uso de medios de cultivo definidos y células preseleccionadas es un paso hacia el establecimiento de los cultivos estandarizados. El uso de medios de cultivo libres de suero y extracto de pituitaria bovina (BPE) permite la generación de sistemas de modelos de vías respiratorias 3D predictivos y reproducibles y ofrece varias ventajas, tales como:
- Condiciones de cultivo definidas y controladas
- Variabilidad reducida en la composición cualitativa y cuantitativa del medio de cultivo.
- Menor riesgo de contaminación microbiana
- Mayor similitud de las condiciones fisiológicas in vivo
- Reducción o incluso prevención del sufrimiento de fetos y animales.
La heterogeneidad en los resultados es común cuando estás realizando experimentos con células primarias. Por ejemplo, una falta de formación de la barrera, eso puede ocurrir debido a la variabilidad de los donantes, ya que las células epiteliales bronquiales de donantes que han estado bajo medicación crónica tienen una función de barrera muy permeable.
Para resolver este problema, los investigadores pueden utilizar células primarias preseleccionadas que han sido evaluadas específicamente para cultivos ALI. Éstas aseguran valores TEER (Transepithelial electrical resistance) altos y estables y, por lo tanto, una función de barrera óptima. Las células preseleccionadas también se pueden utilizar como controles positivos estándar para comparar los resultados experimentales.
Dado que las células epiteliales de las vías respiratorias están involucradas en procesos inmunológicos de inflamación y tolerancia, la expresión del antígeno leucocitario humano (HLA) en esas células es información relevante para la investigación. Por lo tanto, el uso de células de tipo HLA podría resultar muy útil cuando los investigadores deseen establecer cultivos ALI estandarizados para la investigación respiratoria.
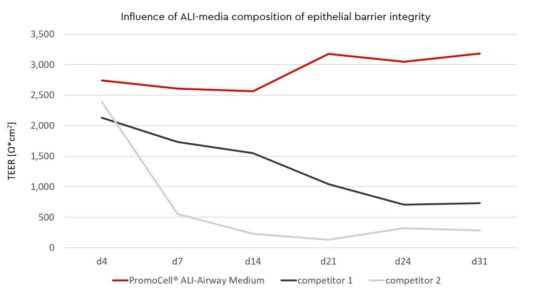
Las composiciones de los medios de la interfaz aire-líquido (ALI) influyen en la integridad de la barrera epitelial
Seleccionar un medio apropiado es un paso crucial para desarrollar un cultivo ALI con una función de barrera duradera.
La formación de la barrera de células epiteliales se puede medir cuantitativamente mediante la resistencia eléctrica transepitelial (TEER) con un voltohmímetro. Para establecer cultivos ALI se puede usar el medio de interfaz aire-líquido (ALI-Airway), de Promocell, las células (Human Bronchial Epithelial Cells – HBEpC) deben sembrarse en Transwell® recubiertos con colágeno tipo I y permitir que crezcan hasta el 100% de confluencia en medio de crecimiento de células epiteliales de las vías respiratorias en un cultivo sumergido.
La siembra de células en pases tempranos es mejor, dónde el pase 3 da resultados óptimos. Después de alcanzar la confluencia, el medio debe cambiarse a ALI-Airway Medium y las células deben exponerse al aire (airlift).
Para monitorear la formación de barreras en tiempo real, se puede usar el voltohmímetro con el juego de electrodos STX2 Chopstick® que no daña las células.
En la primera semana del cultivo ALI puede alcanzar valores TEER >100Ω*cm², valores que han demostrado ser fisiológicamente relevantes en epitelio de las vías respiratorias de conejo (Bath, 1993) y gracias al ALI-Airway medium, la barrera mantiene un nivel estable.
En la segunda semana de contacto ALI, se consiguen valores TEER > 500 Ω*cm2 para HBEpC.
Incluso en las semanas 3 y 4 después de comenzar, la integridad de la barrera de cultivo ALI no disminuirá por debajo de un umbral de > 500 Ω*cm2. La integridad óptima de la barrera con un alto grado de células viables (> 70 % de viabilidad) estará disponible durante al menos cuatro semanas. Por lo tanto, la elección del medio ALI correcto es esencial para el éxito de los cultivos ALI.
El uso de los sistemas aire-líquido con células epiteliales para entender las enfermedades pulmonares
Las disfunciones de las células epiteliales son a menudo la causa de enfermedades pulmonares crónicas como el asma y la enfermedad pulmonar obstructiva crónica (EPOC). Los sistemas ALI utilizan células humanas primarias como modelo para dichas enfermedades y permitir una mejor comprensión de los cambios patológicos subyacentes. Además, las células cultivadas pueden exponerse a patógenos, medicamentos en aerosol y sustancias tóxicas, y la contaminación del aire puede usarse para modelar fases de agudas u observar los efectos de fármacos terapéuticos (Mertens et al., 2017).
En un estudio reciente, Mulay et al. aislaron células epiteliales humanas de la tráquea y los bronquios superiores y las diferenciaron en sistemas ALI durante 16-20 días hasta que se formó un epitelio mucociliar pseudoestratificado. Luego, el equipo infectó estos cultivos ALI con SARS-CoV-2 y observó la replicación del virus y la expresión génica en las células infectadas. Los cultivos ALI de las vías respiratorias, junto con los organoides alveolares 3D, se utilizaron para estudiar el efecto de un panel seleccionado de fármacos como IFNB1, Remdesivir e hidroxicloroquina en la infección y replicación viral.

La ventaja de los sistemas ALI es que proporcionan un método para probar su cultivo de células epiteliales con cualquier agente de interés. Se pueden utilizar contaminantes del aire, sustancias tóxicas, virus, bacterias o fármacos para observar las reacciones de las células a estos agentes. El sistema es una alternativa válida a los experimentos in vivo o a los métodos clásicos in vitro.
Si quieres saber más sobre los sistemas ALI o quieres probar los medios de Promocell en tus cultivos, no dudes en escribirnos en el siguiente formulario:










Deja tu respuesta