La inmunofluorescencia (IF) es una técnica utilizada para visualizar una proteína de interés en su contexto celular. Se basa en la tinción de células con anticuerpos generados contra una proteína diana que se conjuga directamente con un fluorocromo o se usa junto a un anticuerpo secundario conjugados. En esta entrada de blog, intentaremos dar respuesta a todas las preguntas relacionadas con esta técnica.
Como responder a esta pregunta de la forma más eficiente.
Dra. Karolina Szczesna, Senior Product Manager & Technical Support en Proteintech
- Introducción
- Microscopia confocal vs. campo amplio
- Principales ventajas de ambos tipos de microscopia
- ¿Qué microscopio se adapta mejor a mi experimento?
- Puesta a punto del microscopio y selección de controles internos
Introducción
La microscopía de fluorescencia es una técnica de imagen utilizada en biología para investigar la localización celular de una proteína. Esta técnica se basa en el uso de anticuerpos que se unen de forma específica a proteínas en muestras de células o tejido. Estos anticuerpos pueden estar unidos directamente a fluorocromos o pueden ser utilizados conjuntamente con anticuerpos secundarios unidos a fluorocromos.
Los estudios de inmunofluorescencia requieren que se utilice la técnica de microscopía de fluorescencia. Este tipo de microscopio utiliza la fluorescencia para generar imágenes. Las sondas fluorescentes (e.g. Faloidina conjugada con unida para el estudio del citoesqueleto), los colorantes o dyes (e.g. FITC, TRICT, Texas Red, Coralite) o también, el uso de proteínas (e.g. GFP, RFP, Venus) son utilizados para ser unidos a anticuerpos. Estos son utilizados para absorver la luz de un determinado espectro (excitación) y emitir una luz de menor energía y mayor longitud de onda (emisión). La mayoría de los microscopios de fluorescencia actualmente en uso son microscopios de campo amplio de epifluorescencia, donde la excitación y la detección de una señal se realizan a través de la misma trayectoria de luz (el objetivo). Estos microscopios son muy utilizados en biología y son la base para diseños de microscopios más avanzados, como el microscopio confocal (Figura 1).
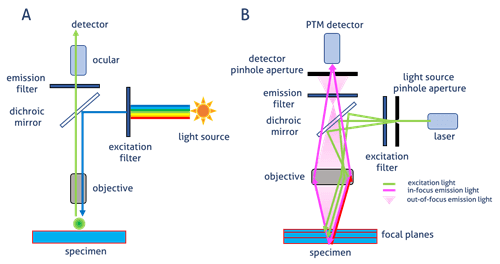
Figura 1. Generación de la imagen en: A) Campo Amplio o bien B) Confocal
Microscopia confocal vs. campo amplio
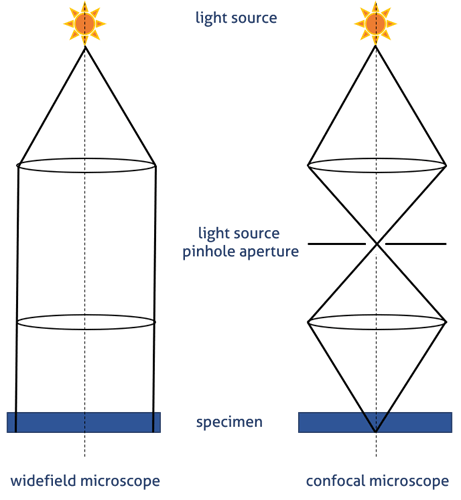
Figura 2. Rutas de la luz en microscopia de campo amplio y en confocal- visualización del principio del poro.
En un microscopio de campo amplio (Figura 1-A), mayoritariamente se utilizan fuentes de luz de mercurio, lásers y luces LED. La fluorescencia emitida por la muestra marcada, se enfoca en el detector mediante el mismo objetivo que se usa para la luz de excitación. El espejo dicroico actúa como un filtro específico de longitud de onda que transmite fluorescencia al ocular o bien a un detector.
En un microscopio confocal (Figura 1-B), la luz es emitida por un láser. Una longitud de onda de luz específica pasa a través de un orificio y es reflejada por el espejo dicroico hacia la muestra. El orificio permite que solo la luz del plano de enfoque llegue al detector. Esto reduce la adquisición de luz fuera de foco, lo que mejora la calidad de la imagen (Figura 2). El fluorocromo excitado emite fluorescencia secundaria que pasa a través del espejo dicroico y se enfoca como un punto confocal en el poro del detector del fotomultiplicador (PTM).
Los microscopios de campo amplio recogen la luz emitida de múltiples planos focales, enfocados y desenfocados. El orificio de los microscopios confocales bloquean la captación de la mayoría de luz no enfocada y permite la detección de un único plano (Figura 2). Es por ello, que este tipo de microscopio permite generar imágenes enfocadas, nítidas y bien enfocadas. Ello conlleva a que también sea necesario disponer de detectores más sensibles ya que la luz que llega es más tenue.
Principales ventajas de ambos tipos de microscopia
Los microscopios de campo amplio se caracterizan por ser significativamente más baratos que los microscopios debido a que disponen de una óptica menos complicada y una menor demanda de la fuerza de la fuente de luz. La principal ventaja de un microscopio de campo amplio es que permite obtener imágenes de forma rápida y permite observarlas directamente en el ocular. Además, el coste del mantenimiento es bajo en comparación con el microscopio confocal. No requieren tiempos de exposición largos, con lo que son buenos instrumentos para captar objetos en movimiento en la preparación.
Además, el microscopio de campo amplio no es una buena opción para captar imágenes de elementos que dispersan mucha luz o con poco grosor, como por ejemplo las preparaciones de tejidos en portaobjetos. También existe el riesgo de sangrado de canal a canal (esto ocurre cuando los fluoróforos tienen perfiles espectrales superpuestos). Además, las bandas de longitud de onda de excitación dependen de los conjuntos de filtros disponibles; Esto puede ser una limitación.
Usando un microscopio confocal, podemos obtener una calidad de imagen superior y mejorar la relación señal-ruido de fondo. Debido a la dispersión de la luz, la imagen borrosa puede ser eliminada fácilmente. La flexibilidad que otorga un microscopio confocal en términos de excitación y emisión de longitud de onda reduce el sangrado canal a canal. La ampliación puede ajustarse electrónicamente y también es posible unir grandes superficies de la muestra. Además, un microscopio confocal nos brinda un examen claro y permite la reconstrucción 3D de muestras gruesas debido a la exploración exhaustiva de diferentes planos en el eje de las Z. Sin embargo, el uso de microscopio confocal puede conllevar mucho tiempo (dependiendo de la velocidad de escaneo). Además, el procedimiento de adquisición de imágenes es más complicado en comparación con un microscopio de campo amplio. Las imágenes confocales solo se obtienen digitalmente desde el detector PMT (la señal observada a través de la lente ocular es en realidad una imagen de campo amplio).
¿Qué microscopio se adapta mejor a mi experimento?
Para la mayoría de los experimentos, un microscopio de fluorescencia de campo amplio es más que suficiente y proporciona la mejor compensación entre calidad, velocidad, facilidad de uso y coste. Por lo tanto, es una herramienta perfecta para las etapas iniciales de los experimentos y para obtener capturas de células in vivo en que la velocidad de adquisición ofrece una ventaja sobre el escaneo utilizando confocal (si la relación señal-ruido para una tinción en concreto es suficiente) .
En general, se considera una buena práctica verificar en primer lugar la calidad de la tinción de nuestras muestras para microscopía confocal utilizando un microscopio de campo amplio (Figura 3). Los microscopios confocales son imprescindibles si se pretende co-localizar dos proteínas ya que aporta mayor sensibilidad espacial. Por ejemplo, es recomendable utilizar un microscopio confocal para estudios de localización subcelular o de interacción proteína-proteína, colocalizaciones, imágenes en 3D de tejidos gruesos o superficies más grandes de una muestra (unión entre campos). También es compatible con imágenes de fluorescencia múltiple, imágenes de lapso de tiempo, FLIM y mediciones FRAP.
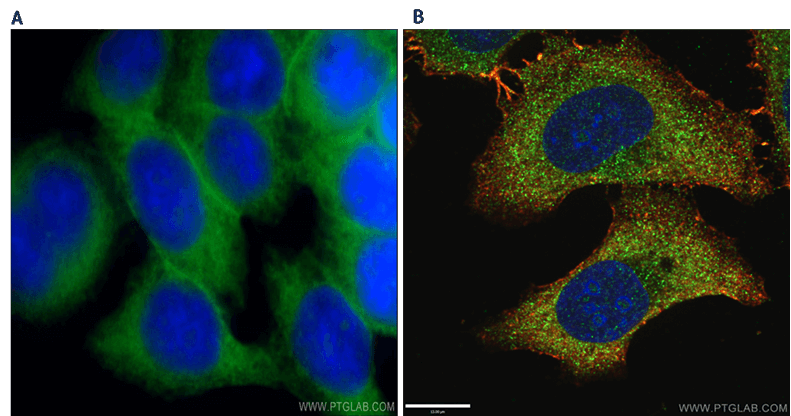
Figura 3. A) Análisis de la immunofluorescencia de células HeLa utilizando los anticuerpos SLC2A1 y GLUT1 (21829- 1-AP) a una dilución 1:50 combinado con un Alexa Fluor 488-conjugado con AffiniPure Goat Anti-Rabbit IgG(H+L) en microscopio de campo amplio. B) Análisis de la inmunofluorescia (-20°C Etanol) células HepG2 fijadas y utilizando el anticuerpo LAMP1 (55273-1-AP) a una dilución de 1:50 y combinado con Alexa Fluor 488-conjugado con AffiniPure Goat Anti-Rabbit IgG(H+L) mediante microscopio confocal. DAPI fue utilizado para marcar el nucleo celular.
Puesta a punto del microscopio y selección de controles internos
La configuración del microscopio y la selección de controles internos son pasos críticos para la obtención de imágenes de IF. Algunos puntos importantes a considerar se enumeran a continuación:
- Utilizar muestras incubadas solo con el anticuerpo secundario es un control negativo importante para evaluar el ruido de fondo y el potencial marcaje no específico. Utilizar muestras sin expresión (o expresión muy baja) de la proteína de interés (e.g. células KO o células tratadas con siRNA) y muestras que sobre-expresen la proteína de interés.
- Si más de un anticuerpo se utiliza, se deben utilizar algunas muestras que estén incubadas únicamente con un único anticuerpo para asegurar que el señal es dependiente del canal.
- Es imprescindible utilizar fluoróforos que tengan longitud de onda de emisión/excitación compatibles con el microscopio que estamos utilizando.
- Optimización del protocolo (e.g. tampón de blocking, tiempos de incubación, dilución del anticuerpo, etc.) para reducir el background y generar imágenes de mayor calidad.




Deja tu respuesta