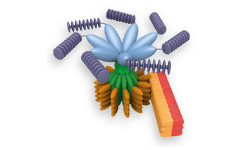
Un inflamasoma representa un complejo de alto peso molecular que activa las caspasas inflamatorias y activa las citocinas de la familia IL-1. Se han descrito varios inflamasomas y hasta ahora estaban definidos por la proteína NLR que contienen: el inflamasoma NLRP1 (NALP1), el inflamasoma NLRP3 (NALP3) y el inflamasoma IPAF (NLRC4).
Introducción
Curiosamente, el inflamasoma AIM2, descrito recientemente, no contiene ningún miembro de la familia NLR. Los Iiflammasomas pueden activarse a través de múltiples señales, incluyendo bacterias, toxinas de origen microbiano, xenobióticos, PAMPs y DAMPs. Se sugiere que los dominios LRR de NLRP3 median la autorepresión, probablemente a través de las chaperonas SGT1 y HSP90 que mantienen NLRP3 en un estado inactivo. Al detectar sus respectivos ligandos, NLRP1 o NLRP3 se oligomerizan a través del dominio NACHT, lo que conduce a la agrupación de PYD y al reclutamiento de la proteína adaptadora ASC (proteína tipo speck asociada a apoptosis) debido a interacciones homotípicas PYD-PYD. En el caso de AIM2, la oligomerización es probablemente mediada por la agrupación en múltiples sitios de unión dentro de dsDNA y no por un dominio de oligomerización central como NACHT.
Las caspasas inflamatorias se acercan lo que permite la autoactivación y la formación de la caspasa activa. En el caso de la procaspasa-1, se forma un tetrámero p10 / p20 después de la autoescisión. Además de la caspasa-1, NLRP1 también puede reclutar caspasa-5 para el complejo, pero el papel de la caspasa-5 todavía está en debate. Al contrario de NLRP1, NLRP3 y AIM2, IPAF no recluta una molécula adaptadora, sino que interactúa directamente con la procaspasa-1 a través de su dominio CARD (consulte la Figura a continuación). Sin embargo, dependiendo del estímulo de IPAF, la activación máxima de caspasa-1 en sentido descendente de IPAF puede requerir ASC o NAIP. El ensamblaje de los diferentes inflamasomas provoca una cascada downstream. Sin embargo, la caspasa-1 parece ser la caspasa inflamatoria dominante asociada con los inflamasomas. Todas las caspasas inflamatorias tienen un dominio CARD seguido de un dominio que contiene el residuo catalítico cisteína y se denominan caspasas inflamatorias porque sus sustratos principales son citoquinas (como pro-IL-1β, pro-IL-18 y eventualmente pro-IL-33) Que se escinden a su forma activa y secretada. Además, la activación del inflamasoma puede llevar a la muerte de la célula huésped en ciertos tipos de células, conocida como piroptosis. Se cree que la piroptosis es importante para restringir la replicación intracelular de patógenos invasivos.
Inflamasomas – Regulación de la actividad
Aunque los mecanismos que regulan la actividad del inflamasoma siguen siendo poco conocidos, se identificaron varias proteínas que pueden interferir con la activación del inflamasoma y el procesamiento de la caspasa inflamatoria dependiente del inflamado. En general, se pueden distinguir dos subtipos de reguladores del inflamasoma: los que contienen un dominio CARD y los que tienen un dominio PYD. Dichas proteínas abarcan no solo los reguladores del inflamasoma derivados del huésped, sino también diversos factores de virulencia bacteriana que inhiben la activación de caspasa-1 y las proteínas virales PYD.
Inflamasomas – Implicaciones Terapéuticas
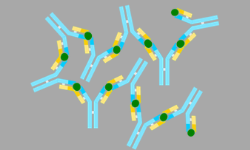
Como la IL-1β y otras citoquinas son actores clave en la respuesta inflamatoria, es tentador especular que la IL-1β, las caspasas inflamatorias y los inflamasomas desempeñan un papel importante en varias enfermedades (consulte la Figura a continuación). De hecho, algunas enfermedades hereditarias o adquiridas en humanos se han relacionado con una elevada IL-1β, algunas de las cuales pueden tratarse con antagonistas contra la IL-1β o su receptor. Varias enfermedades, conocidas como síndromos periódicos asociados a la criopirina (CAPS), se han relacionado directamente con mutaciones de NLRP3. Además, la gota, una enfermedad autoinflamatoria caracterizada por una inflamación severa de las articulaciones, está asociada con la deposición de cristales de MSU en las articulaciones, entre otras características. Como la MSU es un potente agonista del inflamasoma NLRP3, se cree que la IL-1β regulada por el inflamasoma ejerce un papel patógeno en la gota. Además, la secreción de IL-1β por el inflamasoma NLRP3 se desencadena por un alto nivel de glucosa extracelular en las células b. La IL-1β elevada es un factor de riesgo para el desarrollo de Diabetes Mellitus Tipo 2 (T2DM) y contribuye a la resistencia a la insulina. Esto funciona como un sensor para el estrés metabólico, como en la forma de urato monosódico (MSU) o hiperglucemia, la NLRP3 Es probable que el inflamasoma contribuya a la patogénesis de la gota o la DMT2, respectivamente. Además, varios reguladores del inflamasoma tienen una relevancia significativa en las enfermedades. En pacientes con FMF (fiebre mediterránea familiar), se demostró que la pirina estaba mutada. Los niveles elevados de IL-1β en la enfermedad autoinflamatoria PAPA (artritis piógena, pioderma gangrenoso y acné) se asocian con mutaciones en PSTPIP1, una proteína que interactúa con la pirina. En conjunto, esto indica la importancia de los reguladores de pirina e inflamasoma en las enfermedades autoinflamatorias y puede permitir nuevos puntos de entrada para el tratamiento de la enfermedad.
-
Inflamasomas – Implicaciones Terapéuticas
Como la IL-1β y otras citoquinas son actores clave en la respuesta inflamatoria, es obvio especular que la IL-1β, las caspasas inflamatorias y los inflamasomas desempeñan un papel importante en varias enfermedades (como muestra la imagen de la derecha). De hecho, algunas enfermedades hereditarias o adquiridas en humanos se han relacionado con niveles elevados de IL-1β. Varias enfermedades, conocidas como síndromes periódicos asociados a la criopirina (CAPS), se han relacionado directamente con mutaciones en el gen NLRP3. Esta enfermedad autoinflamatoria está caracterizada por producir una inflamación severa de las articulaciones, está asociada con la deposición de cristales de MSU en las articulaciones, entre otras características. Como la MSU es un potente agonista del inflamasoma NLRP3, se cree que la IL-1β regulada por el inflamasoma ejerce un papel patógeno en la gota. Además, la secreción de IL-1β por el inflamasoma NLRP3 se desencadena por un alto nivel de glucosa extracelular en las células b. La IL-1β elevada es un factor de riesgo para el desarrollo de Diabetes Mellitus Tipo 2 (T2DM) y contribuye a la resistencia a la insulina. Esto funciona como un sensor para el estrés metabólico, como en la forma de urato monosódico (MSU) o hiperglucemia, la NLRP3 Es probable que el inflamasoma contribuya a la patogénesis de la gota o la DMT2, respectivamente.
Además, varios reguladores del inflamasoma tienen una relevancia significativa en las enfermedades. En pacientes con FMF (fiebre mediterránea familiar), se demostró que la pirina estaba mutada. Los niveles elevados de IL-1β en la enfermedad autoinflamatoria PAPA (artritis piógena, pioderma gangrenoso y acné) se asocian con mutaciones en PSTPIP1, una proteína que interactúa con la pirina. En conjunto, esto indica la importancia de los reguladores de pirina e inflamasoma en las enfermedades autoinflamatorias y puede permitir nuevos puntos de entrada para el tratamiento de la enfermedad.
-
-
Determinación de los inflamasomas
Los inflamasomas son complejos de múltiples proteínas implicados en la inflamación fisiológica y patológica. El inmonoblot para caspasa-1 es el método estándar para detectar la activación del inflamasoma, pero esta técnica presenta ciertas dificultades técnicas, en particular con la elección de protocolos de precipitación, separación y transferencia de proteínas. Los pasos de unión y activación también son cruciales para obtener un resultado de inmunoblot exitoso. A continuación se enumeran los Protocolos de Springer de la Serie de Métodos y Protocolos que utilizan los Anticuerpos Estándar que Adipogen para la detección de Inflammasomas.
-
| AG-20B-0042 | anti-Caspase-1 (p20) (mouse), mAb (Casper-1) | Measuring the Inflammasome | Download Protocol |
| Immunoblotting for Active Caspase-1 | Download Protocol | ||
| Inflammasome Activation and Inhibition in Primary Murine Bone Marrow-Derived Cells, and Assays for IL-1α, IL-1β, and Caspase-1 | Download Protocol | ||
| AG-20B-0044 | anti-Caspase-1 (p10) (mouse), mAb (Casper-2) | Measuring the Inflammasome | Download Protocol |
| AG-20B-0048 | anti-Caspase-1 (p20) (human), mAb (Bally-1) | Measuring the Inflammasome | Download Protocol |
| Cell-Free Assay for Inflammasome Activation | Download Protocol | ||
| AG-20B-0014 | anti-NLRP3/NALP3, mAb (Cryo-2) | Measuring NLR Oligomerization I: Size Exclusion Chromatography, Co-immunoprecipitation, and Cross-Linking |
Download Protocol |
| Functional Reconstruction of NLRs in HEK293 Cells | Download Protocol | ||
| AG-25B-0006 | anti-Asc, pAb (AL177) | Measuring Inflammasome Activation in Response to Bacterial Infection | Download Protocol |
| Measuring NLR Oligomerization II: Detection of ASC Speck Formation by Confocal Microscopy and Immunofluorescence |
Download Protocol |





Deja tu respuesta