¿Estás empezando ha realizar experimentos de inmunohistoquímica por primera vez? Aunque te sientas a gusto realizando esta técnica, ¿sigues buscando más consejos para mejorar tu protocolo? A estas, y otras preguntas vamos a intentar dar respuesta en la entrada de blog.
- 1. Preparación de la muestra
- 2. Recuperación de epítopo
- 3. Manejo de las muestras
- 4. Permeabilización
- 5. Bloqueo
- 6. Escoger el anticuerpo primario
- 7. Anticuerpos de control
- 8. Dilución del anticuerpo
- 9. Lavados
- 10. Detección
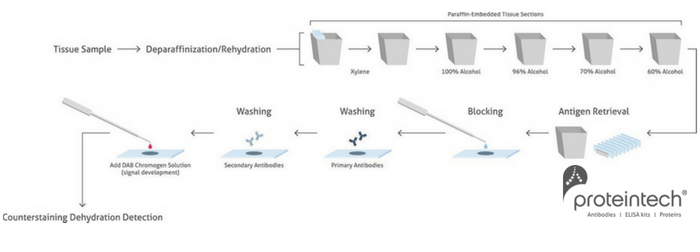
La inmunohistoquímica o también conocida por sus siglas: (immunohistochemistry; IHC), permite visualizar proteínas en un tejido intacto y que retiene su microestructura. Una de las ventajas de esta visualización «en tiempo real» es que permite la comparación del estado de un tejido enfermo en relación a uno sano, por ejemplo. Esta técnica tiene un valor incalculable tanto para científicos cómo para patólogos. El protocolo de IHC es claro y directo, sin embargo, contiene ciertos pasos que requieren una optimización inicial para asegurar que un anticuerpo se une de forma específica y que ello permite visualizar de forma correcta una proteína diana. En esta entrada de blog, vamos a dar énfasis a estos pasos clave y además resaltaremos aquellos pasos que requieran más atención.
1. Preparación de la muestra
Las muestras de tejido pueden ser procesadas mediante congelación o por fijación. De forma general, congelando las secciones se consigue que la conformación de la proteína diana quede inalterada. Ello permite que el anticuerpo se una con más afinidad. Sin embargo, la congelación genera pequeños cristales de hielo, es por ello que no se recomienda el uso de las preparaciones después de un largo periodo de almacenamiento.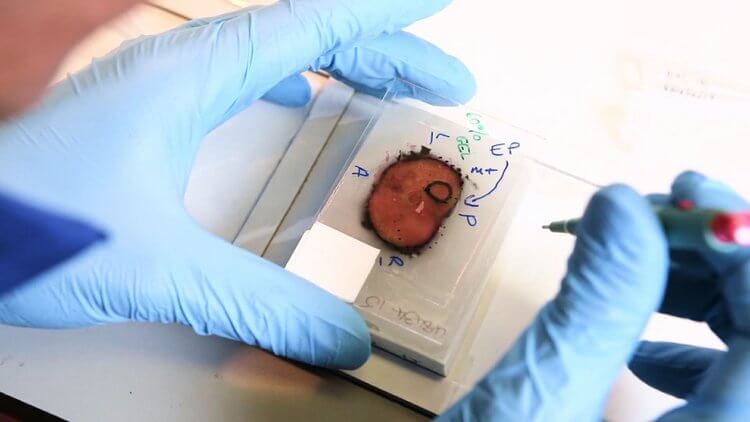
Por contra, el procedimiento más utilizado para fijar e incluir tejidos es mediante fijación con formaldehido (FFPE de las siglas en inglés: formaldehyde fixation with paraffin embedding). ¡Esta metodología permite almacenar estas secciones a temperatura ambiente durante un periodo de tiempo indefinido!
Otros usuarios, con el fin de aumentar la afinidad del anticuerpo primario, prefieren fijar las muestras con una solución 50:50 (v/v) de metanol:acetona o un bien al 4% de paraformaldehido (PFA).
2. Recuperación de epítopo
La fijación con formaldehido causa reticulación de proteínas en el tejido. La principal ventaja es que permite mantener la estructura del tejido pero desnaturaliza los epítopos de a reconocer por el anticuerpo. Es por ello que la recuperación del antígeno se suele realizar mediante aumento de temperatura o enzimáticamente. Estos factores (temperatura y pH) deben ser testados y puestos a punto. Llegados a este punto, se recomienda utilizar una batería de métodos para cada par de anticuerpo y tejido a testar. De esta manera, dispondremos de la combinación de tratamientos que más se adapta a un anticuerpo en un tejido concreto.
Un buen punto de partida consiste en hervir en tampón citrato a pH 6.0 un minuto o dos en el microondas. En secciones congeladas no es necesario realizar recuperación de antígeno. A pesar de esto, los portaobjetos deben ser secados al aire durante al menos una hora antes de iniciar la tinción. Posteriormente, las muestras son tratadas con xileno y rehidratadas con alcohol y agua desionizada.
3. Manejo de las muestras
Una vez las muestras han sido rehidratadas, es importante no dejarlas deshidratar. Utiliza una bandeja o cubeta específica para obtener una cámara húmeda y así llevar a cabo tus experimentos de IHC. Alternativamente, si no dispones de una de estas cámaras, puedes diseñar una utilizando papel de cocina humidificado en agua.
Un truco realmente bueno, consiste en utilizar un PAP pen – un marcador especial que proporciona una fina capa hidrofóbica cuando se dibuja alrededor de una muestra – para mantener las disoluciones únicamente en las regiones de interés. Su uso no es esencial pero puede ser de gran utilidad ya que te permitirá ahorrar anticuerpo.
4. Permeabilización
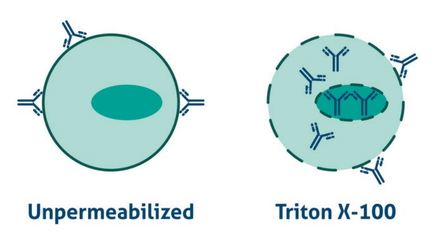 Para muchas proteínas es muy recomendable añadir un paso de permeabilización al protocolo. Para proteínas transmembranales, puede ser un paso evitable ya que los epítopos suelen estar en la parte extracelular. La permeabilización implica el tratamiento con un detergente (for ejemplo Triton-X100 disuelto en PBS). Un buen truco si la tinción no funciona, es intentar añadir un detergente como el Triton a concentración baja en todas las disoluciones que preparemos (en especial si estamos trabajando con FFPE).
Para muchas proteínas es muy recomendable añadir un paso de permeabilización al protocolo. Para proteínas transmembranales, puede ser un paso evitable ya que los epítopos suelen estar en la parte extracelular. La permeabilización implica el tratamiento con un detergente (for ejemplo Triton-X100 disuelto en PBS). Un buen truco si la tinción no funciona, es intentar añadir un detergente como el Triton a concentración baja en todas las disoluciones que preparemos (en especial si estamos trabajando con FFPE).
5. Bloqueo
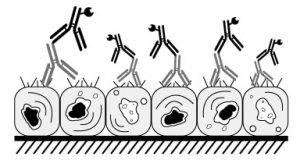
La solución de bloqueo se une a lugares de unión que no son específicos dentro del tejido con el fin de prevenir la unión no específica de los anticuerpos primario y/o secundario. Las secciones se incuban con una solución proteica que es inocua al progreso de nuestra IHC, un buen ejemplo es la albúmina sérica bovina o también conocida por sus siglas en inglés: BSA. También podríamos utilizar suero del huésped utilizado en el anticuerpo secundario. Un buen comienzo puede ser iniciar con una solución 3% de BSA e incubar durante 20 o 30 minutos.

Alternativamente, utilizar una dilución entre el 5% y el 10% de suero de cabra (¡siempre que el anticuerpo secundario se haya producido en esta especie!) puede ser un buen punto de partida para la puesta a punto del protocolo.
6. Escoger el anticuerpo primario
Para escoger qué anticuerpo se adapta mejor a nuestra muestra tendremos que tener en cuenta factores como: los niveles de expresión de la proteína de interés en ese tejido y que otros anticuerpos se pueden utilizar en ese tejido para realizar la co-localización. Deberás utilizar anticuerpos producidos en diferentes especies con el fin de poder distinguirlos a la hora de incubar con los respectivos anticuerpos secundarios. Por otro lado, deberás tener en cuenta si un anticuerpo monoclonal o bien policlonal se adapta más a tus necesidades. Los anticuerpos monoclonales ofrecen un señal más específico mientras que los policlonales pueden ofrecer más señal en casos en que los niveles de expresión de la proteína de interés sean bajos.
7. Anticuerpos de control
Existen algunas opciones para testar la especificidad de un anticuerpo primario.
- El control ideal para testar la especificidad de un anticuerpo primario sería utilizar un tejido que no contenga la proteína de interés, como por ejemplo, el tejido de un ratón knock-out o células en que la proteína diana se ha silenciado mediante un siRNA.
- La técnica de western blot se suele utilizar para detectar si la proteína de interés tiene el tamaño correcto. Si se detectan múltiples bandas en la membrana, ello indica que el anticuerpo no es capaz de detectar de forma específica.
- La especificidad del anticuerpo se puede chequear mediante pre-incubación del anticuerpo primario con el péptido antigénico (test de adsorción). Este proceso no es necesario en aquellos anticuerpos purificados por afinidad.
- Si es anticuerpo ha sido generado de forma casera, se recomienda hacer un WB utilizando sueros de diferentes etapas del proceso de obtención del anticuerpo, para determinar si la banda que representa a tu proteína es detecta en las fracciones correctas de la etapa de purificación del anticuerpo.
 [/vc_column_text][/vc_column][/vc_row]
[/vc_column_text][/vc_column][/vc_row]
8. Dilución del anticuerpo
Normalmente, se proporciona una guía de las diluciones a testar conjuntamente con el anticuerpo. De todas formas, diluciones desde 1:50 a 1:300 son buenos puntos de partida para iniciar la optimización del protocolo. Se recomienda realizar un panel de diluciones cada vez que se adquiera un nuevo anticuerpo. En general, una vez diluido el anticuerpo en solución de bloqueo (por ejemplo, 3% de BSA en PBS), incuba durante 1 o 2 horas a temperatura ambiente o bien toda la noche a 4ºC.
9. Lavados
Los lavados para eliminar el exceso de anticuerpo primario se suelen realizar con PBS. Un lavado rápido seguido de tres lavados de duración igual a 5 minutos es más que suficiente. Las secciones congeladas pueden ser un tanto frágiles, de tal forma que es recomendable verter la solución de lavado utilizando una pipeta Pasteur. En buen truco es utilizar Tris-buffered Saline (TBS) en vez de PBS.
10. Detección
La detección del anticuerpo primario se suele realizar utilizando anticuerpos secundarios contra inmunoglobulinas de la especie huésped en que se ha realizado el anticuerpo primario. Estos anticuerpos secundarios pueden estar conjugados a un fluoróforo (por ejemplo FITC) o bien a una enzima cromogénica (como por ejemplo la peroxidasa de rábano; horse-radish peroxidase HRP). Lee atentamente los siguientes consejos para tener éxito en el último paso del protocolo!
- El background o ruido de fondo puede variar entre experimentos. Añade siempre un control negativo, es decir una muestra en la que se ha omitido la incubación con anticuerpo primario.
- Diluye el anticuerpo secundario en solución de bloqueo y en un factor de dilución entre 1:800 y 1:1000.
Otros consejos a tener en cuenta en experimentos con fluorescencia son los siguientes:
- Comprueba que el fluoróforo que pretendes detectar puede ser utilizado en tu microscopio. Es importante evitar espectros que se solapan y evitar la reactividad cruzada entre anticuerpos secundarios.
- Mantén las secciones en la oscuridad una vez los anticuerpos fluorescentes se hayan añadido con el fin de prevenir que se pierda el señal.
- Después de la incubación, lava las secciones muchas veces con PBS antes de añadir el medio de montaje. Además, ten cuidado al añadir el cubreobjetos a la preparación.
- Evita que se produzcan burbujas en el momento en que añadas el cubreobjetos especialmente en secciones congeladas. Y recuerda, no aprietes el cubreobjetos demasiado fuerte, ¡podrías romper el tejido!
- Es bastante habitual teñir el nucleo, como por ejemplo con DAPI. Este paso puede ser incluido durante un lavado o bien en el momento de añadir el medio de montaje.
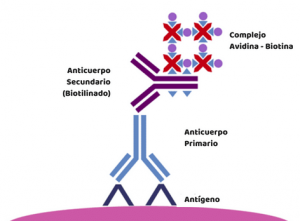
- Es posible utilizar anticuerpos primarios directamente conjugados con fluoroforos. Este paso, ahorra tiempo y reduce falsos positivos. Sin embargo, el señal obtenido puede ser bajo. Por suerte, existen métodos para aumentar este señal como incluir un complejo avidina-biotina (ABC) y unirlo con streptavidina-biotina (LSAB).
Resumen de los principales pasos del protocolo:
¿Tienes dudas?
Si no te queda claro del todo cómo funciona esta tecnología, o quieres que te ayudemos a configurar tu ensayo, nuestro departamento técnico de especialistas, con amplia trayectoria en investigación (todos PhD), te pueden echar una mano: por mail (tecnic@labclinics.com), por tlf +34.934464700 o de forma presencial. Contáctanos y estaremos encantados de poder ayudarte!





Deja tu respuesta