El desarrollo del cáncer es un proceso multifásico en el que las células sanas adquieren características que les llevan a convertirse en células tumorales.
1) Introducción
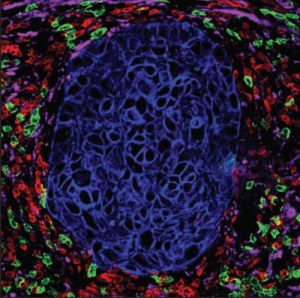 El microambiente tumoral (MAT) se caracteriza por presentar concentraciones bajas de O2, un pH bajo y altas concentraciones de ácidos grasos. Estos niveles altos de ácidos grasos son producido por las células cancerosas como subproducto metabólico. Las células mieloides supresoras prosperan con estas altas concentraciones de ácidos grasos vía oxidación de ácidos grasos (FAO). Estas condiciones apoyan el crecimiento tumoral al suprimir las células T que normalmente atacarían el tumor.
El microambiente tumoral (MAT) se caracteriza por presentar concentraciones bajas de O2, un pH bajo y altas concentraciones de ácidos grasos. Estos niveles altos de ácidos grasos son producido por las células cancerosas como subproducto metabólico. Las células mieloides supresoras prosperan con estas altas concentraciones de ácidos grasos vía oxidación de ácidos grasos (FAO). Estas condiciones apoyan el crecimiento tumoral al suprimir las células T que normalmente atacarían el tumor.
Aunque no es el principal mecanismo, ciertos agentes quimioterapéuticos inhiben la FAO, sensibilizando las células dentro del microambiente tumoral hasta la muerte por inanición («starvation«) [1,2]. Es por ello que reproducir el microambiente tumoral in vitro nos puede ayudar a comprender mejor cómo se comportan las células en este entorno. Sin embargo, muchas veces es difícil de simular este microentorno [3]. Para simular el entorno microtumoral utilizamos una combinación de compuestos para inhibir los transportadores de los principales vías bioenergéticas de la mitocondria (Figura 1). Estos compuestos fueron utilizados para examinar la flexibilidad (capacidad y dependencia) de las células cancerosas y de las células mieloides supresoras para evaluar la dependencia a la oxidación del piruvato, al metabolismo de la glutamina y/o al metabolismo mediado la FAO mediante un Test de actividad mitocondrial.
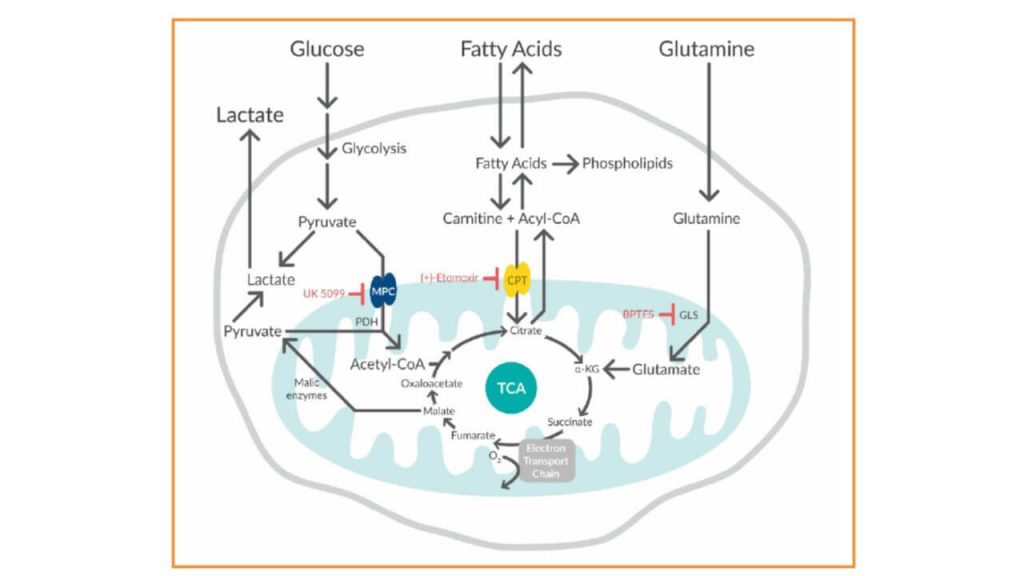
Figure 1. Three pathway inhibitors demonstrate the flexibility of cells to use glucose, glutamine, and fatty acids as mitochondrial fuel sources. MPC=mitochondrial pyruvate carrier; CPT=carnitine palmitoyltransferase; GLS=glutaminase.
2) Métodos
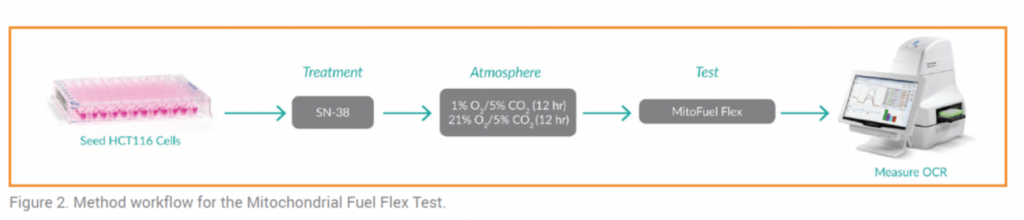
• Cultivo de células de carcinoma de colon humano HCT116: las placas de 96 pocillos se trataron con el agente quimioterapéutico SN-38 o bien con vehículo control y se mantuvieron en un ambiente normal en oxígeno (21% O2 / 5% CO2) o bajo en oxígeno (1% O2 / 5% CO2) [O2] (Figura 2).
• Aislamiento de las células mieloides supresoras: una vez diferenciadas a partir de monocitos aislados de sangre completa. Después de 4 días, las células se mantuvieron al 1% de O2/5% de CO2 o al 21% O2/5% CO2 durante el resto del período de diferenciación (6 días en total) antes de ser analizadas.
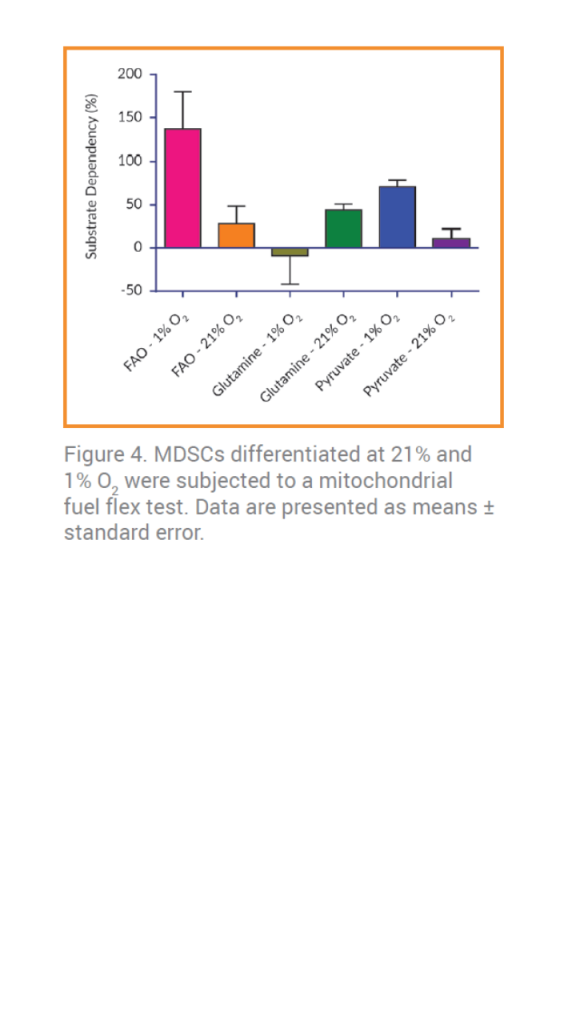
• Prueba del combustible mitocondrial: para evaluar la capacidad y la dependencia de la FAO, la glutamina y el piruvato se determinaron mediante la administración de (+)-etomoxir (2 μM), para inhibir la CPT1 (FAO), para inhibir la oxidación del piruvato mitocondrial se utilizó UK 5099 (4 μM) y para evaluar la inhibición de la glutamina se utilizó BPTES (3 μM). La tasa de consumo de oxígeno (OCR) se midió usando un instrumento Seahorse XFe96. Los valores de OCR en los puntos de equilibrio se usaron para calcular el porcentaje de utilización del sustrato para la oxidación del piruvato, el metabolismo de la glutamina y la FAO después de la exposición a diversas combinaciones de conjuntos de inhibidores.
3) Resultados
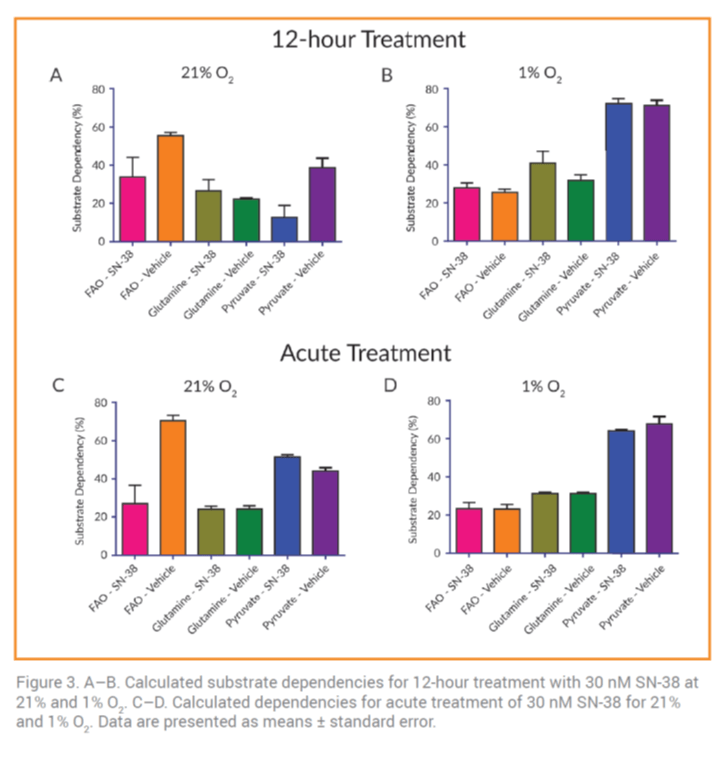 Cuando las células HCT116 fueron tratadas con SN-38 con dos tipos de tratamiento: agudo o durante 12 horas. La capacidad de oxidación de piruvato, glutamina y la FAO no cambió significativamente (datos no mostrado). Esto sugiere que bajo concentraciones normales de oxígeno, las células HCT116 son más dependientes de la FAO. En cambio, al 1% de [O2], la exposición aguda a SN-38 aumentó la dependencia de células HCT116 al piruvato (Figura 3B y 3D). Esta observación era esperada ya que aumenta la glucólisis regulada por la disponibilidad del piruvato.
Cuando las células HCT116 fueron tratadas con SN-38 con dos tipos de tratamiento: agudo o durante 12 horas. La capacidad de oxidación de piruvato, glutamina y la FAO no cambió significativamente (datos no mostrado). Esto sugiere que bajo concentraciones normales de oxígeno, las células HCT116 son más dependientes de la FAO. En cambio, al 1% de [O2], la exposición aguda a SN-38 aumentó la dependencia de células HCT116 al piruvato (Figura 3B y 3D). Esta observación era esperada ya que aumenta la glucólisis regulada por la disponibilidad del piruvato.
En contraste con estos resultados, las células mieloides supresoras cultivadas al 21% de [O2] tienen una mayor dependencia a la glutamina (Figura 4). En cambio, en condiciones reductoras de oxígeno, se produce un cambio en la dependencia del sustrato a favor de la FAO.
4) Conclusiones
Las condiciones de cultivo, particularmente la concentración de oxígeno, puede tener un impacto significativo en la utilización del sustrato metabólico. La habilidad de la célula para modificar el tipo de combustible mitocondrial en un entorno controlado y utilizando una combinación de inhibidores que inhiben rutas metabólicas específicas representa una oportunidad de observar células bajo condiciones que son una mejor representación de un entorno nativo.
 Con una comprensión crítica de cómo se reprograma la utilización del sustrato y la actividad metabólica, se pueden desarrollar nuevas estrategias para modular las enzimas y los transportadores que impulsan las mitocondrias. Conocer los factores que afectan la desregulación de glucosa, lípidos y/o homeostasis de aminoácidos durante enfermedades como diabetes, obesidad, enfermedades del hígado graso, mitocondriales trastornos, insuficiencia cardíaca, neurodegeneración y cáncer mejorarán el descubrimiento de terapéutica.
Con una comprensión crítica de cómo se reprograma la utilización del sustrato y la actividad metabólica, se pueden desarrollar nuevas estrategias para modular las enzimas y los transportadores que impulsan las mitocondrias. Conocer los factores que afectan la desregulación de glucosa, lípidos y/o homeostasis de aminoácidos durante enfermedades como diabetes, obesidad, enfermedades del hígado graso, mitocondriales trastornos, insuficiencia cardíaca, neurodegeneración y cáncer mejorarán el descubrimiento de terapéutica.
5) Referencias
1. Schumacher, J.D. and Guo, G.L. Mechanistic review of drug-induced steatohepatitis. Toxicol. Appl. Pharmacol. 289(1), 40–47 (2015).
2. Begriche, K., Massart, J., Robin, M.A., et al. Drug-induced toxicity on mitochondria and lipid metabolism: Mechanistic diversity and deleterious consequences for the liver. J. Hepatol. 54(4), 773–794 (2011).
3. Vander Heiden, M.G. Exploiting tumor metabolism: Challenges for clinical translation. J. Clin. Invest. 123(9), 3648–3651 (2013).






Deja tu respuesta