Sabemos como de complicado puede resultar diseñar un panel multicolor para citometría de flujo. En esta entrada de blog, queremos recoger los principales trucos o consejos para ayudarte a diseñar tu panel. Los temas escogidos son los siguientes:
- 1) Familiarízate con tu citómetro de flujo
- 2) Preparar correctamente la muestra
- 3) Eliminar las células muertas
- 4) Optimizar el protocolo de tinción
- 5) ¿Es interesante incluir un control isotipo?
- 6) Citometría intracelular y posibles problemas con la permeabilización
- 7) Construye paneles de citometría multicolor
- 8) Multicolor panel control
- 9) Conocer tus maracdores de interés
- 10) Trata tus fluoróforos con cuidado
1) Familiarízate con tu citómetro de flujo
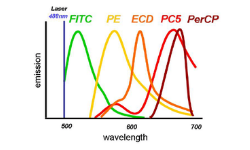
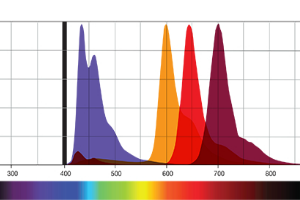
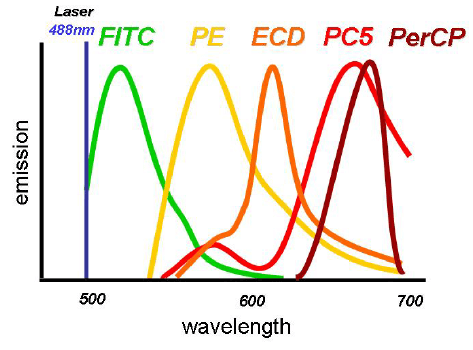 Es importante ser consciente de las capacidades que tiene nuestro citómetro de flujo. Muchos de los nuevos citómetros disponen de tres o más láseres, desde el ultravioleta (355 nm), violeta (405 nm), azul (488 nm), amarillo (561 nm) y, rojo (640 nm). Además de los láseres, también se incluyen filtros específicos y detectores que determinan la configuración. Estos componentes definirán cuantos colores pueden ser detectados simultáneamente. En el caso de los citómetros de nueva generación, este número puede ser superior a 17 marcadores.
Es importante ser consciente de las capacidades que tiene nuestro citómetro de flujo. Muchos de los nuevos citómetros disponen de tres o más láseres, desde el ultravioleta (355 nm), violeta (405 nm), azul (488 nm), amarillo (561 nm) y, rojo (640 nm). Además de los láseres, también se incluyen filtros específicos y detectores que determinan la configuración. Estos componentes definirán cuantos colores pueden ser detectados simultáneamente. En el caso de los citómetros de nueva generación, este número puede ser superior a 17 marcadores.
2) Preparar correctamente las muestras
Células mal preparadas proporcionarán resultados subóptimos y generará un aumento en la autofluorescencia y por lo tanto aumentará el background. Es importante tratar bien las células durante el proceso de preparación de la suspensión celular evitando los procesos de agitación mediante vortex. Durante la tinción, las células deben estar preferiblemente en hielo (siempre que el experimento lo permita). Para reducir la formación de agregados, hecho que podría bloquear el flujo celular, evita utilizar una densidad alta. La adición DNase I o EDTA puede ser de ayuda a la hora de reducir el número de agregados.

3) Eliminar las células muertas
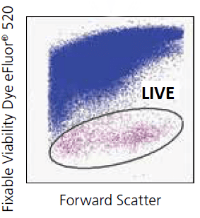
La presencia de células muertas puede producir falsos positivos debido a la autofluorescencia que generan. Éstas no siempre pueden ser eliminadas mediante FSC o SSC, es por ello que se recomienda utilizar un marcador de viabilidad. Echa una ojeada a nuestra entrada de blog en la que hablamos de marcadores de viabilidad en citometría de flujo. Marcadores como el yoduro de propidio (Propidium Iodide (PI)) o el 7AAD (7-AAD Viability Staining Solution) son utilizados para identificar células muertas, pero no pueden ser utilizados en células fijadas.
4) Optimizar el protocolo de tinción
La unión no específica de anticuerpos debido a la interacción directa proteína-proteína puede provocar la aparición de falsos positivos. Se puede reducir este número tratando la muestra con BSA (Bovine Serum Albumin) con el fin de bloquear estas interacciones inespecíficas. Además, muchas células (e.g. células B, células NK o macrófagos) presentan receptores Fcγ en la superficie celular que pueden unirse a la región Fc de tu anticuerpo, provocando unión inespecífica. Concentraciones elevadas de anticuerpo, también pueden provocar unión inespecífica. Utilizar concentraciones apropiadas de anticuerpo es crucial para citometría de flujo multicolor.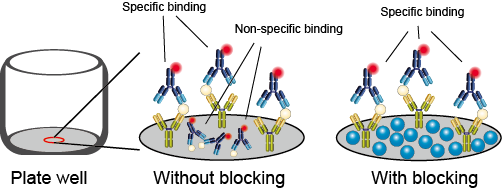
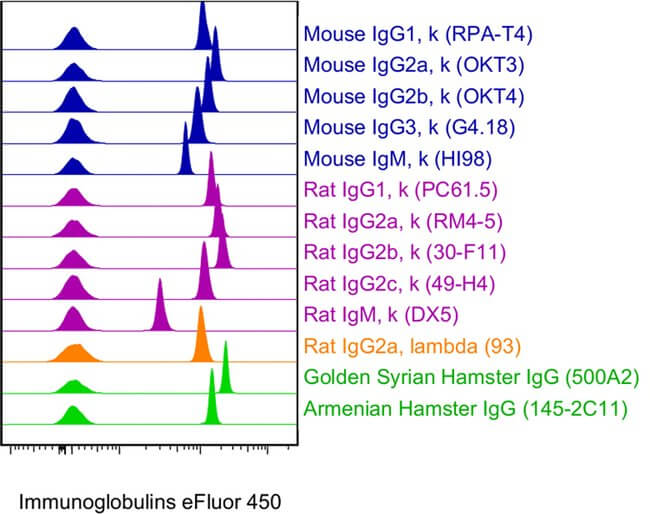
5) ¿Es interesante incluir un control isotipo?
Asegúrate que incluyes los controles isotipo apropiados. Los controles isotipo han sido desarrollados para reconocer marcadores de superficie y determinar la especificidad. Por tanto, un control isotipo correcto es aquel que ha sido generado contra un antígeno irrelevante (e.g. KLH) de la misma subclase de anticuerpo y conjugado con el mismo fluoróforo, el cual se ha obtenido del mismo proveedor que el anticuerpo a testar. El objetivo es asegurar que el marcaje no es debido a unión específica del anticuerpo.
Soy un bloque de texto. Haz clic en el botón Editar para cambiar este texto. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.
6) Citometría intracelular y posibles problemas con la permeabilización
La tinción intracelular puede resultar mucho más problemática que el marcaje de superficie. En estos casos, el control isotipo no resultará de ayuda. Existen diferentes protocolos para la permeabilización de las muestras. En nuestra entrada de blog, puedes echar un vistazo a nuestras recomendaciones para citometría de flujo intracelular. Disponemos de reactivos comerciales como el eBioscience™ Fixation / Permeabilization Diluent . Evita el uso de marcadores unidos a Biotina o a FITC en marcaje intracelular, en la medida de lo posible.
7) Construye tus paneles de citometría multicolor
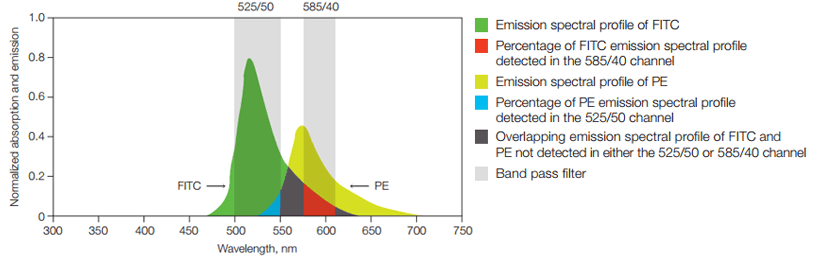
En el momento en que dos fluoróforos se solapan, uno de los fluoróforos es detectado dentro del canal de detección vecino (e.g. para el FITC y el PE). Todo esto puede dificultar la identificación de las poblaciones si no se utiliza la técnica de la compensación. No siempre es posible realizar compensación al utilizar varios fluoróforos diferentes. Se recomienda utilizar fluoróforos que no se solapen para marcadores para prevenir la pérdida de sensibilidad o fluorescencia.
 8) Controles del Panel Multicolor
8) Controles del Panel Multicolor
Para paneles multicolor, los controles de compensación marcadors son esenciales para calcular los valores de compensación. Por otro lado, los controles de fluorescencia menos uno (FMO) pueden determinar la propagación de la fluorescencia, los límites de activación y ayudar a evitar una sensibilidad reducida.
9) Conocer tus marcadores de interés
Los fluoróforos con índice de tinción más brillante (como el PE) funcionan mejor para células con menor expresión del antígeno o en la subpoblación más pequeña, mientras que los fluoróforos más tenues están más recomendados para antígenos más expresados. Sin embargo cuando utilizamos diferentes colores, es posible que sea necesario hacer concesiones debido a la disponibilidad de fluoróforos, anticuerpos y/o la configuración del citómetro de flujo.
10) Trata tus fluoróforos con cuidado
A medida que aumentemos la cantidad de colores en nuestro panel, necesitaremos utilizar dyes en tándem como PE-Alexa Fluor® 647 o el APC-Cy7, que aumenta el rango de emisión de un solo láser. Sin embargo, son propensos a la degradación por exposición a la luz. El brillo de los dyes en tándem pueden reducirse debido a la fijación o permeabilización, por lo que idealmente estos pasos deben ser tan suaves como sea posible. Además, los valores de compensación deben obtenerse de muestras tratadas de manera idéntica para tener en cuenta estos factores.





Deja tu respuesta