La naturaleza sensible de la PCR permite a los científicos extraer y amplificar secuencias concretas de ADN. A pesar de esto, esta elevada sensibilidad puede crear problemas ya que se pueden provocar que se amplifiquen secuencias incorrectas. En esta entrada de blog, vamos a explorar algunos detalles a tener en cuenta durante nuestro protocolo.
- 1) Introducción
- 2) Distribución en el laboratorio
- 3) Flujo de trabajo unidireccional
- 4) Técnica de pipeteo
- 5) Cambio frecuente de guantes
- 6) Limpieza de las superficies de trabajo
- 7) Incluir controles en nuestro protocolo
1) Introducción
 Una de las grandes ventajas de la PCR es su exquisita sensibilidad. Comenzando con pequeños fragmentos de ácido nucleico (llamados cebadores o primers), se pueden sintetizar más de 10 millones de copias de moléculas de ARN o ADN a partir de unas pocas copias de la secuencia objetivo después de solo 32 ciclos de amplificación [1]. La sensibilidad de la PCR permite a los científicos extraer y amplificar el ADN de muestras para obtener perfiles de ADN útiles para el investigador. Si bien este hecho constituye una ventaja para el investigador, también puede crear problemas si no se tiene cuidado para evitar la contaminación con otras fuentes de material genético presentes en el entorno del laboratorio. Estos problemas de contaminación pueden dar como resultado que se amplifique la secuencia incorrecta. En esta entrada de blog, os mostraremos 10 trucos para evitar la contaminación de una PCR.
Una de las grandes ventajas de la PCR es su exquisita sensibilidad. Comenzando con pequeños fragmentos de ácido nucleico (llamados cebadores o primers), se pueden sintetizar más de 10 millones de copias de moléculas de ARN o ADN a partir de unas pocas copias de la secuencia objetivo después de solo 32 ciclos de amplificación [1]. La sensibilidad de la PCR permite a los científicos extraer y amplificar el ADN de muestras para obtener perfiles de ADN útiles para el investigador. Si bien este hecho constituye una ventaja para el investigador, también puede crear problemas si no se tiene cuidado para evitar la contaminación con otras fuentes de material genético presentes en el entorno del laboratorio. Estos problemas de contaminación pueden dar como resultado que se amplifique la secuencia incorrecta. En esta entrada de blog, os mostraremos 10 trucos para evitar la contaminación de una PCR.
2) Distribución en el laboratorio
La prevención de la contaminación de una PCR comienza con la distribución de las zonas: Pre y post-PCR. Se recomienda designar una sala o una poyata específica para Pre-PCR. Y de forma ideal, ésta debe estar dividida en dos áreas: preparación de la mastermix de la PCR y la adición de la muestra a la mastermix.
- La preparación de la muestra puede implicar la extracción manual o automatizada. Debes destinar una zona para mantener los consumibles y el aparataje pequeño (minicentrifugam vórtex, pipetas, puntas con filtro y tubos, etc.).
- También deberá contener los kits de extracción de ácidos nucleicos. Aquí tienes una selección de nuestros kits de extracción de la casa comercial Blirt.
- Finalmente, tu sala pre-PCR deberá contener un refrigerador/congelador. Éste será de utilidad para almacenar componentes de los kits y almacenamiento de muestras.
Como hemos comentado, idealmente deberás establecer una segunda sala (o poyata destinada a ese uso) a la que llamaremos sala Post-PCR. En esta sala realizaremos todos los procesos después de la amplificación. En esta sala podemos alojar los termocicladores y cualquier instrumento necesario para el análisis de PCR, como por ejemplo un transiluminador, cubetas y fuentes de alimentación para cargar y correr geles de agarosa, etc.
3) Flujo de trabajo unidireccional

El flujo de trabajo en un laboratorio de biología molecular es solo en una dirección, es de Pre-PCR > Post-PCR. Los reactivos de la mastermix de PCR y las muestras de DNA deben prepararse siempre en la sala Pre-PCR. Una vez finalizada una amplificación de DNA, en ningún caso deben abrirse o introducirse estos viales de nuevo en la sala de Pre-PCR, ya que estos podrían contaminar fácilmente los reactivos, consumibles o equipos de preparación de muestras.
Esto quiere decir que los consumibles y material de protección del investigador (batas de laboratorio, guantes, gafas protectoras, etc. deben ser independientes en ambas salas. Es decir, muchos de los materiales deberán estar duplicados para evitar posibles contaminaciones. De tal forma que los operarios, necesitan regresar a la zona Post-PCR irán en contra del flujo unidireccional y deberán tener cuidado de no contaminar la sala Pre-PCR.
4) Técnica de pipeteo
En cualquier ensayo, una técnica de pipeteo adecuada es fundamental para el rendimiento y la calidad de los resultados. Además, una técnica correcta de pipeteo minimiza la contaminación entre muestras. Es importante evitar salpicaduras durante la apertura de tubos y placas. Para ello, se recomienda centrifugar los viales antes de ser abiertos, para evitar aerosoles que puedan contener DNA en el medio. 
5) Cambio frecuente de guantes
Es importante utilizar guantes no utilizados durante periodos de tiempo prolongados mientras realizamos una PCR. Si sospechas que puedes haber tocado una superficie u objeto contaminado con DNA exógeno, no lo dudes, cámbiate de guantes en seguida.
6) Limpieza de las superficies de trabajo
Es recomendable realizar una limpieza periódica antes y después del trabajo de PCR. Esto se aplica a todas las superficies de trabajo, incluidas mesas de trabajo, pipetas, manijas del refrigerador/congelador, etc. Una solución es limpiar estas superficies con lejía al 10-15% (hipoclorito de sodio al 0.5-1%), preparada fresca. 15′ más tarde, use papel humedecido con agua desionizada para eliminar los residuos de lejía y a continuación alcohol al 70% para ayudar a secar rápidamente las superficies. Otra posible solución es utilizar los kits de descontaminación de superficies de la casa Minerva Biolabs. Puedes echar aquí un vistazo.
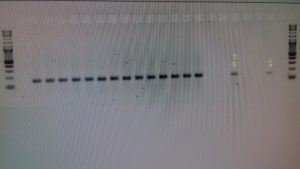
7) Incluir controles en nuestro protocolo
Una buena práctica es incluir un control positivo para asegurar el que el proceso de extracción y amplificación funcionan correctamente. Además, es completamente necesario incluir a nuestro protocolo un control negativo o Non-Template Control (NTC), es decir un control que no contiene muestra. Este control sirve para verificar la ausencia de contaminación en los reactivos, los consumibles y el medio ambiente.








Deja tu respuesta